ORPについて
ORP(酸化-還元電位)は溶液の酸化性、あるいは還元性を示す指標であり、pH測定とよく似た方法で測定されます。
ORP測定は、mV測定機能を有するpH計本体と貴金属電極(白金電極または金電極)と比較電極を用いて測定します。ORPも温度の影響を受けますので、一定温度(たとえば25℃)で測定する必要があります。
表題は「やさしいORPの話」となっておりますが、「ORPの説明は何度聞いても、専門書を開いても解りづらい」、との声をよく耳にします。いま少しお付き合いください。
電気化学あるいは電気分析化学関係の便覧、書籍には酸化-還元電位の例として次の表が必ず掲載されています。
表1 酸化-還元電位
| 電極 | 電極反応 | Eo[V] |
|---|---|---|
Li+, Li | Li+ + e = Li | -3.024 |
K+, K | K+ + e = K | -2.924 |
Na+, Na | Na+ + e = Na | -2.714 |
Al3+, Al | Al3+ + 3e = Al | -1.67 |
Mn2+, Mn | Mn2+ + 2e = Mn | -1.05 |
(Pt) H2 OH- | 2H2O + 2e = H2 + 2OH- | -0.828 |
Zn2+, Zn | Zn2+ + 2e = Zn | -0.761 |
Cr3+, Cr | Cr3+ + 3e = Cr | -0.71 |
Fe2+, Fe | Fe2+ + 2e = Fe | -0.441 |
(Pt) H+ (10-7M) | 2H+(10-7) + 2e = H2 | -0.414 |
Cd2+, Cd | Cd2+ + 2e = Cd | -0.4021 |
In3+, In | In3+ + 3e = In | -0.340 |
Tl+, Tl | Tl+ + e = Tl | -0.338 |
Co2+, Co | Co2+ + 2e = Co | -0.277 |
Sn2+, Sn | Sn2+ + 2e = Sn | -0.140 |
Pb2+, Pb | Pb2+ + 2e = Pb | -0.126 |
Fe3+, Fe | Fe3+ + 3e = Fe | -0.036 |
(Pt) H+, H2 | 2H+ + 2e = H2 | 0.0000 |
(Pt) IO3- , I- , OH- | IO3- + 3H2O + 6e = I- + 6OH- | 0.26 |
Cu2+, Cu | Cu2+ + 2e = Cu | 0.344 |
(Pt) CIO3- , CIO2- , OH- | CIO3- + H2O + 2e = CIO2- + 2OH- | 0.35 |
(Pt) O2 , OH- | O2 + 2H2O + 4e = 4OH- | 0.40 |
Cu+, Cu | Cu+ + e = Cu | 0.5222 |
(Pt) I2 , I- | I2 + 2e = 2I- | 0.5355 |
(Pt) Fe3+ , Fe2+ | Fe3+ + e =Fe2+ | 0.77 |
Hg22+ , Hg | Hg22+ + 2e = 2Hg | 0.7986 |
Ag+, Ag | Ag+ + e = Ag | 0.799 |
Pt2+, Pt | Pt2+ + 2e = Pt | ca 1.2 |
(Pt) Cl2 , Cl- | Cl2 + 2e = 2Cl- | 1.3583 |
(Pt) Ce4+ , Ce3+ | Ce4+ + e = Ce3+ | 1.61 |
Au+, Au | Au+ + e = Au | 1.68 |
Co3+, Co2+ | Co3+ + e = Co2+ | 1.82 |
日本分析化学会『分析化学データブック』 P89(1970).丸善
この表では、酸化-還元電位E0の数値として、プラス(+)側に数値が大きければ還元状態になりやすく、マイナス(-)側に数値が大きければ酸化状態になりやすことを意味しています。
この表からは次のような例が読み取れます。
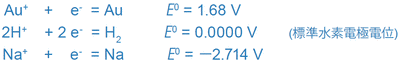
(表1では電子 e と表示されているが、電荷をわかりやすくするため e- とする)
ここに表示された各平衡関係に対応したE0の値は、標準状態(25℃、1気圧)、各イオンの活量*1のときの値(標準酸化-還元電位)を熱力学的に計算して算出されたものです。
ただし、何らかの基準点が必要になるため、標準水素電極**(S.H.E.またはN.H.E.と略す)の電位を E0=0.0000 V at 25℃と定義し、相対的に表示しています。
前記の各平衡系を例にとると、金(Au)は金属状態(いわゆる金)として存在しやすく、ナトリウム(Na)はイオン状態(いわゆるナトリウムイオン)として存在しやすいことが理解できます。関連して、金製の宝飾品と海水中に大量に存在するナトリウムイオン
(あるいはイオン化合物としての食塩)が思い浮かびます。
たとえば、この表1を図1のように縦軸に表示した場合、その相対的な意味、すなわち縦軸の上位にあるものは還元状態になりやすく、下位にあるものは酸化状態になりやすいことが理解できます。
*活量については 「pH測定の基礎 - 理論的なpHの定義 水素イオン活量」の説明を参照してください。
**標準水素電極については「pH測定の基礎 - 比較電極の電位」の説明を参照してください。
図1 標準酸化-還元電位の縦軸表示(月刊誌『電気化学』(1969年版)表紙より)
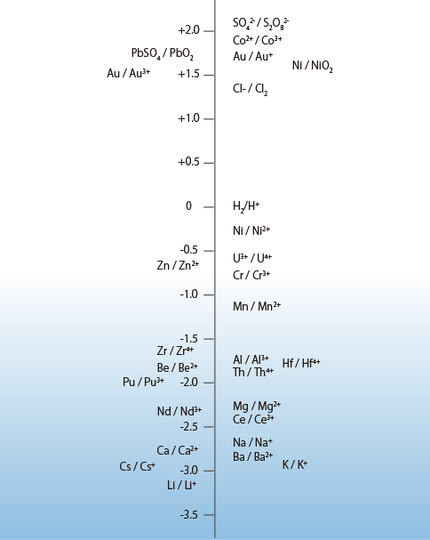
ただし、実際のサンプルのORPは、一種類の平衡状態に基づくものではなく、共存する多くの酸化体と還元体の平衡状態で定まりますので、前述のような単純な説明は不可能となります。
次ページ ORP測定の基礎