理論的なpHの定義
pHの定義の見直し
Sφrensen(セーレンセン)のpHの定義、pH=-log10[H+]について、その後の研究でpHは水素イオン濃度ではなく、水素イオンの活量に関係することがわかりました。その結果、pHの定義は1920年に次のように改められました。
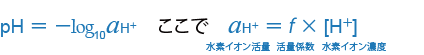
この定義は、現在も理論的なpHの定義として学術・研究分野で認知されており、実際のpHの現場においても、次章「pH測定の応用」で述べるようにこの定義に基いた実用的なpH測定が行われています。この研究には、熱力学や実際のpH測定方法の進歩が重要な役割を果たしました。
水素イオン活量
では、水素イオンの活量とは一体何なのでしょうか。一つの例を挙げてわかりやすく説明しましょう。
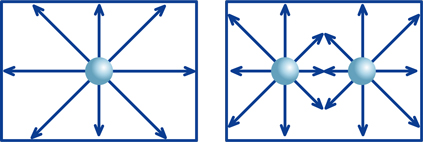
いま、一定の大きさの容器の中に、玉(たとえば、ビー玉)が1個入っていると考えてください。容器内には玉が1個しか入っていないので、このビー玉を弾いたとき、このビー玉は容器内を自由に動くことができます。
次に、この同じ容器に玉が2個入っていたらどうでしょう。2個の玉が衝突する可能性があり、その分だけ玉の動きは制限されます。玉が2個の場合、その制限による影響はそれほどではありませんが、玉が3個、4個、5個…と増加するにつれて玉の動きはより制限されます。
ここで、この制限の度合いを f で表現すると、制限の度合い f × 容器内の玉の数は、自由に動ける玉が何個存在しているかに対応します。
さて、この例えを水溶液の水素イオンに置きかえてみると、玉は水素イオンH+、玉の数は水素イオン濃度[H+]、自由に動ける玉が何個存在しているかが、水素イオン活量になるわけです。そして「自由に動ける」ということは、イオンの場合そのイオンが「固有の性質を発揮できる」ことを意味します。また f は、専門用語で「活量係数」と言います。
以上のことから、次の理論式が得られます。
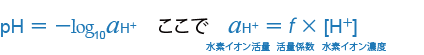
pHの理論的な定義は、このような活量という非常に難しい考え方を用いていることをご理解いただければと思います。

コラム
Sφrensen(セーレンセン)が最初に提唱したpHの定義(つまり、pHが水素イオンの濃度によって決まるという考え方)は、このように科学の進歩とともに若干の修正を受けることになりました。しかし、彼の提案の美点である実用上の価値や、生物学的あるいは化学的な意義を傷つけるものではありません。また、その見直しの過程では熱力学や実際のpH測定方法の進歩が重要な役割を果たしました。それゆえに、SφrensenはpH関係の技術者から見れば「pHの父」と称しても過言ではありません。また、一般化学の初等レベルでの教育においても、pHの理解を容易にするためにSφrensenの最初の定義が活用されています。
次ページ 実用上のpHの定義