ORP測定の基礎

mV(ORP)とは、Oxidation-Reduction Potential の略号で、酸化還元電位のことです。最近ではRedox(レドックス)電位とも呼ばれています。すなわち、溶液中に共存する酸化体(Mz+)と還元体(M(z-n)+)の間の平衡状態によって定まるエネルギーレベル(電位)を意味します。
溶液中に一種類の平衡状態
![]()
①のみが存在するとき、この溶液中に金属電極(白金、金など)と比較電極を挿入し、電位差計(pH計のmV測定機能)を用いて両電極間の電位差mV(ORP)を測定すると、その電位差は一般に次式で示されます。
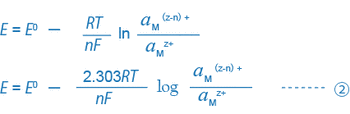
たとえば、3価の鉄イオンと2価の鉄イオンが共存する溶液の場合、①・②式は次のようになります。
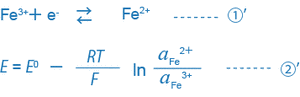
溶液中に1種類の平衡状態①’のみ存在するとき、この溶液のORPは②’式で一義的に決まります。
ここで重要なことは、mV(ORP)は酸化体(Fe3+)と還元体(Fe2+)の活量の比(aFe2+/aFe3+)で決まる点です。しかし、実際には一般の溶液中では各種イオンの間で何種類もの平衡状態が同時に存在するため、このような溶液のmV(ORP)は単純な式で表現できるものではなく、その物理的、科学的な意味はあまり明確ではありません。
このような意味からmV測定は、その溶液の性質を表す尺度の一つであるとして理解する必要があります。しかし、mV測定は溶液の分析(電位差滴定)あるいは廃液処理などに有益な指標として広く用いられています。
また、最近では「mV(ORP)の高さが殺菌作用に効果がある」、「mV(ORP)の低い水を飲むと体内細胞中の活性酸素と反応するので病気になりにくい」と言った説があり、アルカリ飲料水などの指標として使用されることがあります。
基準電極(比較電極)の種類とmV(ORP)
測定によって得られたmV(ORP)は用いた比較電極に対する値であるため、比較電極の種類が異なれば同一溶液のmV(ORP)測定値は見かけ上異なります。堀場製作所の比較電極では、3.33mol/L KClを内部液とするAg/AgClを用いています。
一般の学術論文等では、基準電極として標準水素電極(S.H.E.またはN.H.E.と略す)が用いられることが多く、3.33mol/L KCl-Ag/AgCl電極でのmV(ORP)との関係は次式で示されます。
![]()
EN.H.E. :標準水素電極(N.H.E.)を比較電極としたmV(ORP)測定値
E :3.33mol/L KCl-Ag-AgClを比較電極としたmV(ORP)測定値
本件については、「pH測定の基礎 - 比較電極の電位」の項目を参照してください。
電位符号について
電気化学、分析化学関係の書類には、標準酸化-還元電位として次のような記載がされています。
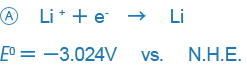
ところが、一部の書籍には+、-の符号が逆に記載されているものがあります(特に米国系の書籍)。
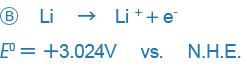
Bのような表現は反応を逆にしているだけであり、本質的に差はありませんが、混乱を招くことがあります。現在世界の大半では、Aの符号に統一されていることから、当社のORPに関する表記もAに統一しています。
本件を国際純正応用化学連合(IUPAC)の「ストックホルム規約」と言います。単純に言えば、主となる化学種が酸化体から還元体となる方向に表記することになります。
次ページ ORP測定の応用