導電率測定の応用


溶液の濃度測定
導電率値から溶液の濃度を求める
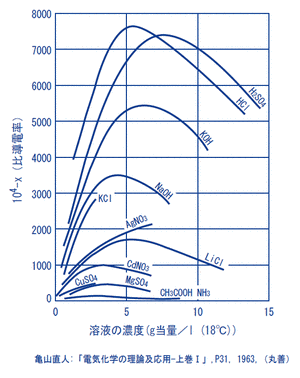
導電率測定値から溶液の濃度を求めることができるため、しばしば工業的に測定されています。
(例:HCl、HNO3、H2SO4、NaCl、NaOHなど)
一般的に電解質溶液は、高濃度においてその導電率が極大値になるので、ある導電率値に対する溶液の濃度が2つ存在することになり注意が必要です。
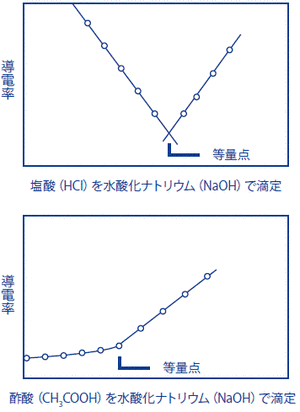
導電率滴定により濃度を求める
測りたい物質Aを含む溶液に、Aと反応する物質Bの溶液(濃度がわかっているもの)を少しずつ加えると、AとBが反応して導電率が変化します。さらに、Bを加えてこれ以上加えても反応が起こらない点(等量点)以降は、加えたBの導電率の増加による変化となります。等量点に達するまでに加えたBの量からAの量を測る方法を「導電率滴定」と言います。
【例1】塩酸(HCI)を水酸化ナトリウム(NaOH)で滴定
H++Cl-+Na++OH- → Na++Cl-+H2O
【例2】酢酸(CH3COOH)を水酸化ナトリウム(NaOH)で適定
CH3COOH+Na++OH- → Na++CH3COO-+H2O
次ページ よくある質問(Q&A)-導電率